骨缺陷修复技术从简单器械固定发展到活体组织重建,从功能替代发展到永久性再生修复。目前,骨移植已成为仅次于输血的第二大移植手术,而人工骨移植为骨缺损的修复和治疗带来了巨大的希望。
开发新型人工骨植入材料以满足复杂骨缺损修复的需求早已成为国际研发热点。近年来,3D 打印技术为解决传统骨组织工程中的诸多难题提供了全新路径。其中,低温沉积 (LTD) 3D 打印技术因其独特优势,正成为制备高性能人工骨修复材料的重要方法。
一、技术简介
低温沉积 (Low-Temperature Deposition, LTD) 是一种新兴的3D打印技术,专为处理生物材料和温敏性材料而设计。该技术通过在低温环境下将生物材料逐层沉积成型,克服了传统3D打印技术因高温操作导致的材料降解、生物活性分子失活等问题,广泛应用于组织工程和生物医学领域。
二、技术原理
低温沉积 (LTD) 3D 打印技术以低温平台为基础,将聚酯等材料在接近室温的温度下溶解于溶剂(如1,4-二氧六环等)中,得到均相的溶液。通过低温沉积打印机在低温环境下将该溶液逐层沉积成型,随后通过冷凝和固化实现三维结构的构建。最后采用冷冻干燥等方法将溶液去除,在贫聚酯相(液-液相分离)或溶剂结晶相(固-液相分离)处形成孔隙结构,从而能够形成贯通性很好的精细微孔结构。打印过程中,低温环境不仅保持了墨水的稳定性,还防止了成型支架的塌陷,确保复杂结构的完整性。并且该工艺过程中没有高温,方便在支架中复合生物活性物质。
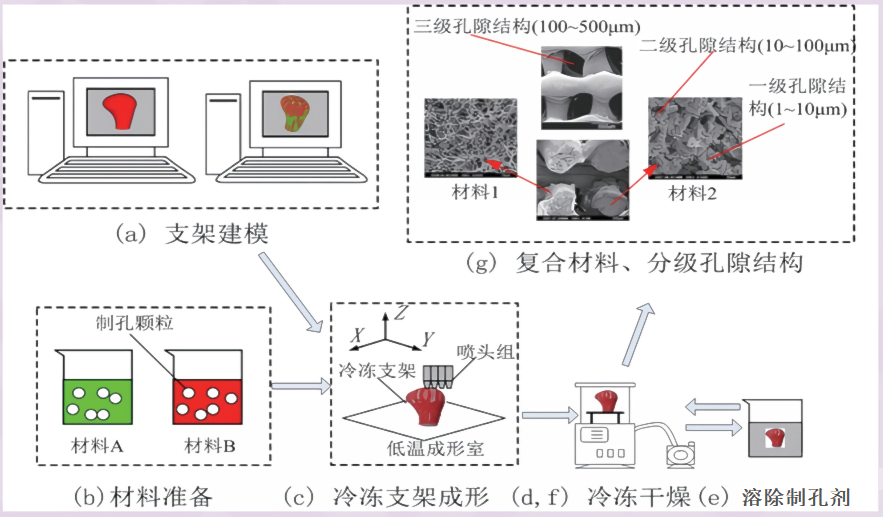
三、核心优势
①保护生物活性分子:低温操作能够保护生长因子、多肽等生物活性分子免受高温破坏,保留其生物功能,增强打印材料的生物学性能。
②精确控制孔隙结构:精确控制孔隙结构:通过调节打印参数,以及在冷冻干燥过程中相分离产生的微孔,LTD 技术可以精确设计微米至纳米级的孔隙结构,为细胞黏附、增殖和组织再生提供理想的支架。
③适应多种生物材料:LTD 技术可处理多种温敏性材料,如含镁可降解高分子骨修复材料,满足多样化的临床需求。
④改善力学性能:低温沉积可实现多层次仿生结构,使打印的骨修复支架兼具良好的机械强度和弹性,适应骨组织的复杂受力环境。
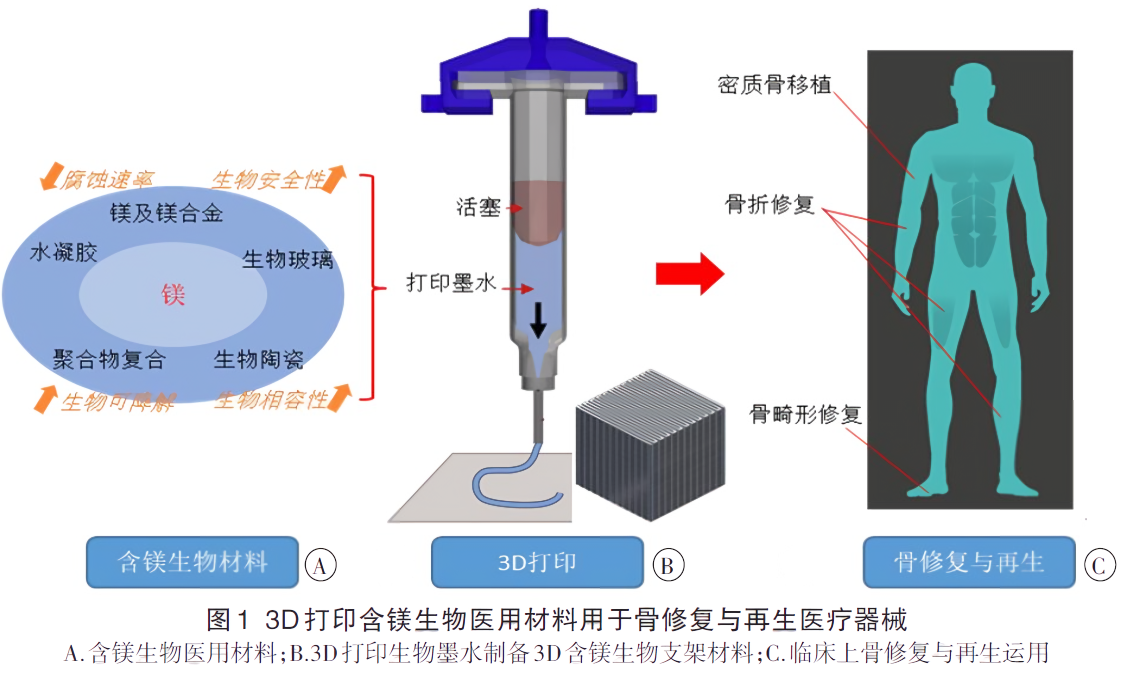
四、典型应用案例
低温沉积 (LTD) 3D 打印技术已广泛应用于骨组织工程支架的制造,尤其是在复杂骨缺损修复中展现了独特优势。例如,通过低温沉积 (LTD) 3D 打印技术打印出来的博骼列®含镁可降解高分子骨修复材料具有以下突出优势,为骨科植入物领域提供了创新解决方案。

①可塑性强,可通过剪切塑型,达到个性化的外部形状,与缺损部位相匹配;
②内部有相互连接的宏观孔-微观孔立体仿生三维结构、高孔隙率,便于骨组织和血管生长;
③力学强度接近人体松质骨,为缺损部位提供结构支撑;
④通过调整含镁可降解高分子骨修复材料组分,达到控制支架降解速率与骨再生速率相匹配的效果;
⑤将可降解金属镁均匀复合入PLGA/β-TCP,使得含镁可降解高分子骨修复材料具有良好的生物相容性、抑制炎症反应,以及优异的成骨活性和骨整合性。
博骼列®即将进入产业化应用阶段
博骼列®含镁可降解高分子骨修复材料是由精诚医学首席科学家秦岭教授、联合创始人之一赖毓霄博士为领衔的香港中文大学、中国科学院深圳先进技术研究院科研团队和精诚医学技术团队共同开发,于2018年获NMPA创新医疗器械特别审批,属国际首创。
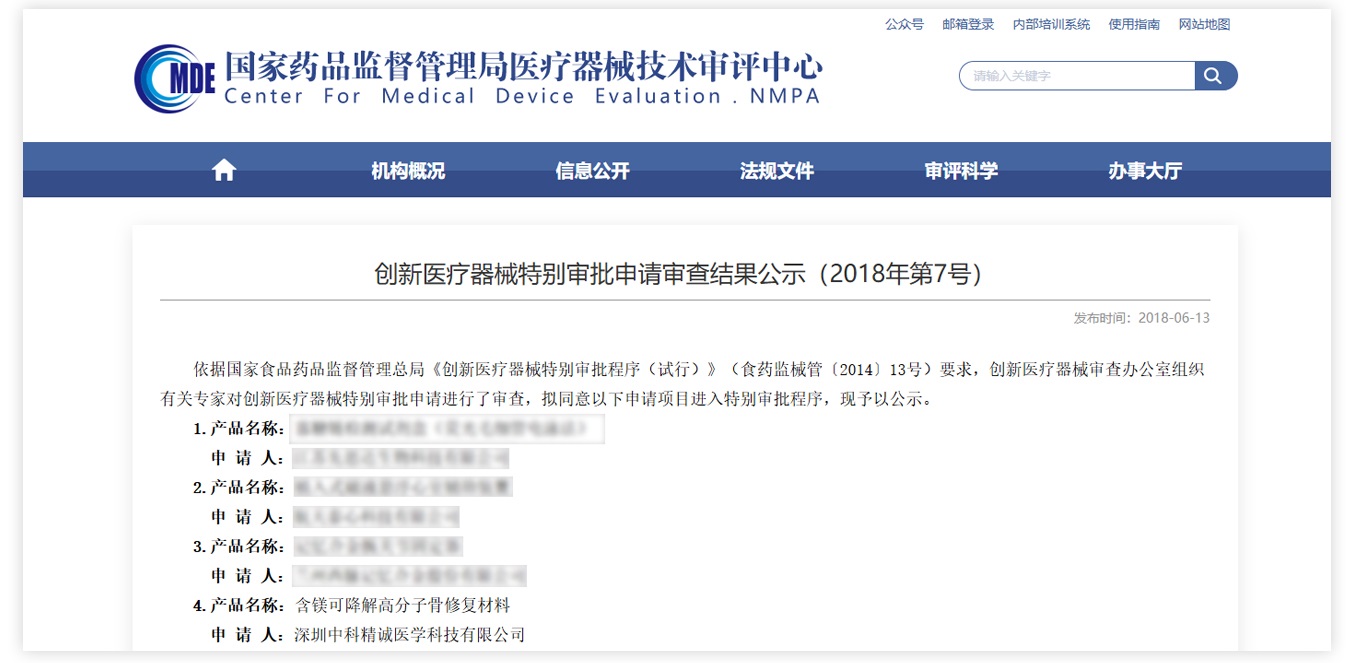
目前已在国家骨科医学中心:北京积水潭医院(牵头单位)、上海市第六人民医院等八家国内大型研究型医院,完成多中心临床试验,展示了良好的安全性和临床治疗效果,预计2025年初可获批,进入全面推广应用阶段。
综上所述,低温沉积 (LTD) 3D 打印技术的创新应用,为骨修复材料的研发开辟了全新的路径。博骼列®含镁可降解高分子骨修复材料作为低温沉积 (LTD) 3D 打印技术应用的典范,不仅解决了传统骨修复材料力学性能与可降解性之间的平衡问题,还在宏观-微观结构的精准设计和生物功能的优化上实现了突破。未来,随着该技术的不断完善,其在骨科医学和组织工程领域的应用前景将更加广阔,为患者提供更高效、更安全的解决方案,同时推动医疗材料科学的持续进步。
参考资料:
[1]《可降解镁基骨科植入物发展、挑战与展望》.秦岭.《医用生物力学》2022年第37卷第4期:581-583
[2]Yifeng Zhang, Jiankun Xu, Ye Chun Ruan, Mei Kuen Yu, Micheal O’Laughlin,Helen Wise, Di Chen, Li Tian, Dufang Shi, Jiali Wang, Sihui Chen, Jian Q Feng,Dick Ho Kiu Chow, Xinhui Xie, Lizhen Zheng, Le Huang, Shuo Huang, KwoksuiLeung, Na Lu, Lan Zhao, Huafang Li, Dewei Zhao, Xia Guo, Kaiming Chan, FrankWitte, Hsiao Chang Chan, Yufeng Zheng*, Ling Qin*.Implantderived magnesium induces local neuronal production of CGRP to improve bonefracture healing in rats. Nat. Med. 2016. 22: 1160-1169.
[3]张剑华, 孙元艺, 郭阿龙, 等.3D 打印含镁生物医用材料用于骨缺损修复研究进展. 中华骨与关节外科杂志, 2021, 14(10): 826-831, 836.
[4] Yuxiao Lai*, Ye Li, Huijuan Cao, Jing Long, Xinluan Wang*, Long Li, Cairong Li, Qingyun Jia, Bin Teng, Tingting Tang, Jiang Peng, David Eglin, Mauro Alini, Dirk W. Grijpma, Geoff Richards, Ling Qin*. Osteogenic Magnesium Incorporated into PLGA/TCP Porous Scaffold by 3D Printing for Repairing Challenging Bone Defect. Biomaterials 2019, 197, 207-219.
[5] Jing Long, Wei Zhang, Yingqi Chen, Bin Teng, Ben Liu, Huilin Li, Zhenyu Yao, Dou Wang, Long Li, Xue-Feng Yu, Ling Qin, Yuxiao Lai*. Multifunctional magnesium incorporated scaffolds by 3D-Printing for comprehensive postsurgical management of osteosarcoma. Biomaterials 2021, 120950.
[6] Rui Ma*, Yuxiao Lai*, Long Li, Hong-lue Tan, Jia-li Wang, Ye Li, Ting-ting Tang*, Ling Qin* . Bacterial inhibition potential of 3D rapid-prototyped magnesium-based porous composite scaffolds–an in vitro efficacy study. Scientific Reports. 5(2015):13775.

