骨肉瘤是最常见的原发性恶性骨肿瘤。骨肉瘤的发病率呈双峰型,高峰年龄为18岁和60岁,男性发病率略高。目前,骨肉瘤的临床治疗模式为手术联合新辅助化疗。局部病变患者的预后已显著改善,无事件生存率超过60%,但转移性病变患者的无事件生存率仍然较低,不足30%[1]。这是因为部分手术切缘区域会残留少量肿瘤细胞,这些残留的肿瘤细胞存在极高的局部复发风险。比如:在四肢骨肉瘤中,与大于1毫米的阴性切缘相比,阳性切缘的存在是局部复发的唯一独立预测因素(风险比为8.006;95%置信区间为1.314-48.781;p=0.0241)[2],而骨盆和脊柱等骨肉瘤即使达到阴性切缘,局部复发率仍较高,可能与解剖限制相关[3, 4]。
根据2018年版的《骨肉瘤临床循证诊疗指南》,大约90%的患者可接受保肢治疗,但化疗反应好仍然是保肢治疗的前提[5]。术前和术后化疗仍存在诸多不足,例如清除残留癌细胞的效率较低,且会产生严重的副作用。同时,肿瘤切除后的大体积骨缺损、化疗导致的免疫力低下、感染以及局部血供不足等问题,都会对缺损部位的愈合和功能重建造成严重影响。因此,研发兼具清除残留癌细胞以抑制肿瘤复发、修复手术所致大体积骨缺损这两种优异功能的新型生物材料,具有十分重要的意义。
金属镁颗粒实现肿瘤光热消融 Photothermal Therapy
传统化疗因全身毒性和耐药性正面临严峻的临床挑战,根据一项系统综述评价,约60-70%的骨肉瘤患者对MAP方案(甲氨蝶呤、阿霉素、顺铂)的化疗敏感,而约30-40%的患者表现出耐药性或低反应性[6]。化疗原理是通过细胞毒性药物(如阿霉素、甲氨蝶呤)直接杀伤高增殖活性的肿瘤细胞,但此类药物缺乏靶向性,易损伤正常组织并容易诱发肿瘤细胞耐药性。例如,阿霉素的全身给药导致心脏毒性,且骨肿瘤局部药物浓度不足,导致复发潜在风险[7]。另外,骨肉瘤组织在术中清除不净、形成的不规则缺损腔隙填充、合适的手术切缘是手术规划时需要考虑的重要问题。
金属镁因其同时具有光热效应、抗肿瘤效应和促进成骨能力被研究人员重视起来。金属镁,像金纳米棒、铁纳米颗粒、黑磷纳米片和氧化石墨烯等材料一样,被证明是一种有效的光热剂,能够高效地将光能转化为局部热能[8, 9]。相比传统化疗方案,这种基于光热剂的光热疗法(Photothermal Therapy,PTT)是一种非侵入性、时空可控、低系统性毒性的新型肿瘤消融治疗策略。原理是通过近红外光(near-infrared,NIR)激发光热剂产生局部高热,选择性杀伤肿瘤细胞[10, 11]。其次,金属镁是可降解金属,可在局部产生碱性和高浓度镁环境(Mg2+、H2、OH-及Mg(OH)2),这些降解产物主要通过调节酸性微环境、抵抗氧化应激、改善肿瘤性炎症、抑制肿瘤细胞增殖、促进凋亡、延缓迁移与侵袭等方面抑制肿瘤生长[12]。近期发表在《Biomaterials》研究表明240 mg/L左右镁可选择性抑制多种骨肉瘤细胞(UMR106、143B、K7M2)的增殖,7天培养后细胞存活率均低于40%,同时能上调Wnt通路中APC、Axin2、GSK3β的表达,下调β-连环蛋白,从而抑制肿瘤细胞致癌性[13]。最后,镁元素可以通过多种途径促进成骨分化。
骨缺损修复与肿瘤光热消融的一体化设计
大部分市面上的骨修复材料功能单一,鲜有抗肿瘤效果的报道。精诚医学推出的含镁可降解高分子骨修复材料产品(商品名:博骼列®,国械注准20253130952)是一款临床可用的,兼具抗肿瘤与促成骨的多功能产品。早在2021年,深圳先进技术研究院的赖毓霄研究员团队与精诚医学研发团队在生物材料学顶刊《Biomaterials》报道了这款多功能支架:采用低温沉积3D打印工艺,内含金属镁粉的多孔多功能支架,可以用于骨肉瘤的综合术后管理[14]。
3.1 3D打印支架的表征:金属镁粉均匀分布在多孔分级支架上(图1)。
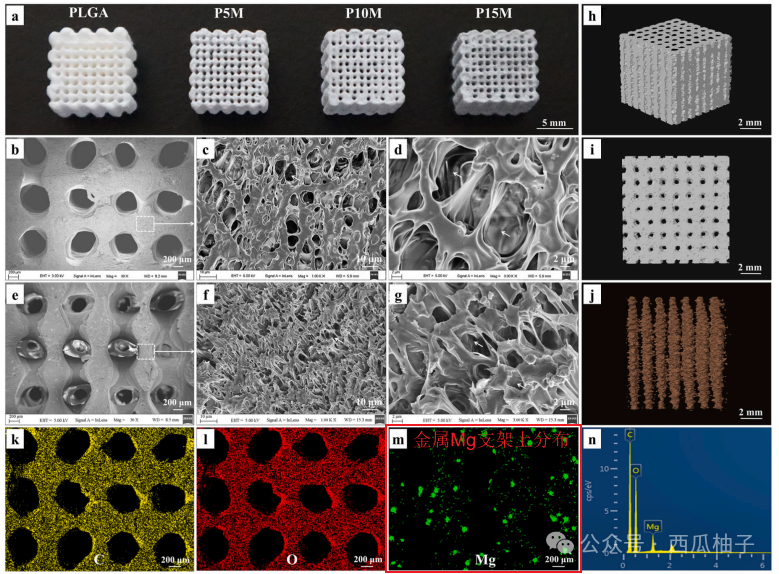
图1 a. 不同成分支架的数码照片;镁颗粒在总成分中的占比分别为 0 wt%(纯 PLGA 支架)、5 wt%(P5M 支架)、10 wt%(P10M 支架)和 15 wt%(P15M 支架)。b-g. 采用扫描电子显微镜(SEM)观察 P10M 支架的形貌:横向截面在 30 倍(b)、1000 倍(c)和 3000 倍(d)放大倍数下的图像;纵向截面在 30 倍(e)、1000 倍(f)和 3000 倍(g)放大倍数下的图像。h-j. 采用显微计算机断层扫描(micro-CT)观察 P10M 支架的结构:重建的 3D 图像(h);横向截面图像(i);互连孔隙(橙色)的重建 3D 图像(j)。k-n. P10M 支架横向截面的扫描电子显微镜能谱仪(SEM-EDS)分析结果:k. 碳元素(C,黄色);l. 氧元素(O,红色);m. 镁元素(Mg,绿色);n. EDS 元素谱图。
3.2 光热消融效应:经近红外照射8min后,材料温度可迅速升高至57±6.73℃。手术切除术后,材料植入的实验组(P10M+NIR)0例复发(图2)。
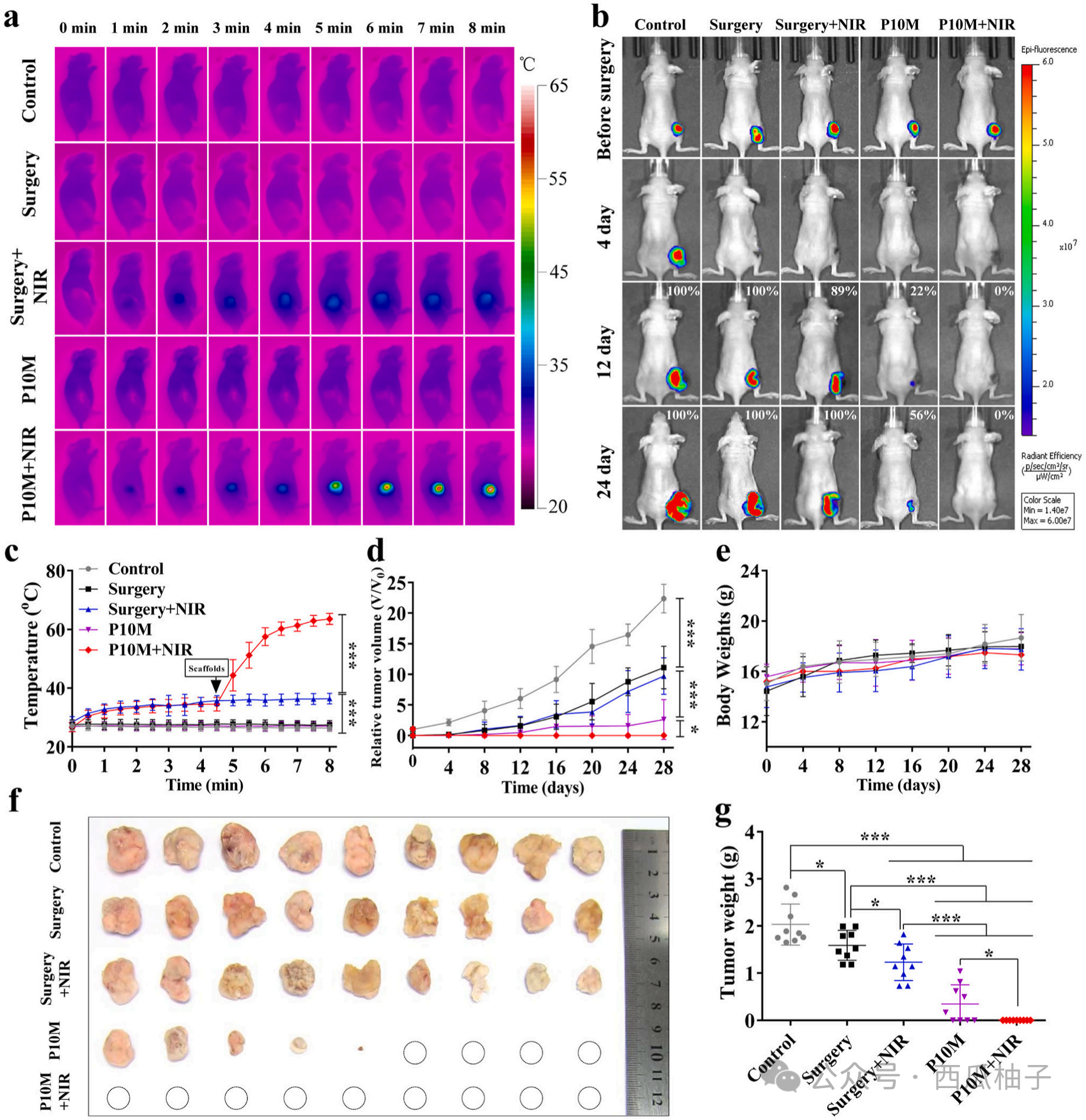
图2 a. 不同处理条件下小鼠的红外热成像图;c. 不同处理条件下小鼠的温度升高曲线。b. 荷瘤小鼠在实体瘤手术切除前,以及接受不同处理后第 4 天、第 12 天、第 24 天的活体成像系统(IVIS)图像。d. 不同组荷瘤小鼠经各种处理后的相对肿瘤生长曲线。e. 不同组小鼠的体重变化情况。f. 第 28 天时,从不同组荷瘤小鼠体内切除的肿瘤的数码照片;g. 第 28 天时,不同组荷瘤小鼠体内切除肿瘤的重量。采用双尾Student t 检验进行统计学分析,*p<0.05,**p<0.01。n=9个生物学独立样本。
写在最后
绝大部分骨肉瘤患者的的生命终结都是因为出现了局部复发和肺转移。尤其是对于化疗效果差的患者,复发转移难以控制,二线治疗比如靶向药和免疫治疗效果没能显著改善患者预后[6]。博骼列®含镁可降解高分子骨修复材料作为上市产品,不仅可以修复骨肉瘤术后的骨缺损,更重要的是可以通过局部释放高浓度镁和红外照射热消融方式抑制肿瘤复发,精准、长效地对局部术后病灶进行治疗,减少再次手术切除概率。该产品目前在小鼠荷瘤实验中获得了0复发的临床前实验效果[14],但是在人体内的效果目前还没有进行临床实验验证和同行评审。未来,以光热效应为代表的响应性生物材料将成为骨肿瘤综合治疗种的关键一环,原因在于其卓越的组织穿透深度、精准的温度调节能力以及生物安全性高等特点。
此外,博骼列®含镁可降解高分子骨修复材料整合了低温3D打印制造工艺,可任意定制不同形状支架、结合光热动态治疗,可构建精准填充贴合缺损、即时肿瘤清除、长效促骨再生的一体化骨肉瘤手术解决方案。
参考文献:
1.Beird, H.C., et al., Osteosarcoma. Nature reviews Disease primers, 2022. 8(1): p. 77.
2.Bertrand, T.E., et al., Do surgical margins affect local recurrence and survival in extremity, nonmetastatic, high-grade osteosarcoma? Clinical Orthopaedics and Related Research®, 2016. 474(3): p. 677-683.
3.Dekutoski, M.B., et al., Osteosarcoma of the spine: prognostic variables for local recurrence and overall survival, a multicenter ambispective study. Journal of Neurosurgery: Spine, 2016. 25(1): p. 59-68.
4.He, F., et al., Effects of resection margins on local recurrence of osteosarcoma in extremity and pelvis: Systematic review and meta-analysis. international Journal of surgery, 2016. 36: p. 283-292.
5.郭卫, 等., 骨肉瘤临床循证诊疗指南. 中华骨与关节外科杂志, 2018. 11(04): p. 288-301.
6.Zhra, M., S.A. Akhund, and K.S. Mohammad, Advancements in Osteosarcoma Therapy: Overcoming Chemotherapy Resistance and Exploring Novel Pharmacological Strategies. Pharmaceuticals, 2025. 18(4): p. 520.
7.Wang, X., et al., Advances and challenges in the treatment of osteosarcoma. Progress in Biophysics and Molecular Biology, 2025.
8.Zhou, W., et al., Micro‐/Nano‐Structures on Biodegradable Magnesium@ PLGA and Their Cytotoxicity, Photothermal, and Anti‐Tumor Effects. Small Methods, 2021. 5(2): p. 2000920.
9.Locatelli, E., et al., Surface chemistry and entrapment of magnesium nanoparticles into polymeric micelles: a highly biocompatible tool for photothermal therapy. Chemical Communications, 2014. 50(58): p. 7783-7786.
10.Xie, M., et al., Advancements in photothermal therapy using near-infrared light for bone tumors. International Journal of Molecular Sciences, 2024. 25(8): p. 4139.
11.Wang, H., et al., NIR-programmable 3D-printed shape-memory scaffold with dual-thermal responsiveness for precision bone regeneration and bone tumor management. Journal of Nanobiotechnology, 2025. 23(1): p. 300.
12.Hsu, Y., et al., Magnesium alloys in tumor treatment: current research status, challenges and future prospects. Journal of Magnesium and Alloys, 2023. 11(10): p. 3399-3426.
13.Gong, G., et al., Implant derived high local concentration of magnesium inhibits tumorigenicity of osteosarcoma. Biomaterials, 2025. 320: p. 123263.
14.Long, J., et al., Multifunctional magnesium incorporated scaffolds by 3D-Printing for comprehensive postsurgical management of osteosarcoma. Biomaterials, 2021. 275: p. 120950.
*仅供医疗专业人士阅读
西瓜柚子团队声明:文章内容来自同行评审研究;但这文章不能替代专业的医疗建议、诊断或治疗。

