镁与骨免疫调节
免疫系统(immune system)在骨再生中扮演着关键角色,不仅作为防御机制清除病原体和坏死组织,还通过主动调节炎症反应,促进成骨血管偶联和调节成骨细胞与破骨细胞的活动来影响骨重塑。因此,国内外研究人员一直在开发能够调节免疫微环境的生物材料,以解决临床多种棘手问题,诸如螺钉无菌性松动,骨不连,股骨头坏死,骨质疏松性骨折等[1]。
镁元素(magnesium)是骨组织中最丰富微量元素,也是全身基本生物活动中不可或缺的活性辅助因子,对生物矿化、酶、蛋白质和核酸的形成至关重要,因而镁离子被认为在骨组织修复中发挥着重要作用,尤其是在骨再生过程中的骨免疫调节[2, 3]。本文主要分为两个部分进行介绍:首先讨论四种免疫细胞各自作用,点明其发挥生理作用的时间点;其次分析含镁元素的骨修复材料如何影响骨免疫过程及临床现状。
第一部分:免疫细胞功能剖析
骨再生受多种免疫细胞调控,不同细胞通过分泌细胞因子、调节细胞极化或与间充质干细胞(MSCs)相互作用,共同影响骨形成与骨吸收平衡。下文整理了几类有“分量”的免疫细胞类群,并按主要发挥生理作用的时间进行排序[4-7]:
数小时至1~3天 中性粒细胞:初期清理与信号传递
中性粒细胞(Neutrophils)作为损伤后首批募集的免疫细胞,中性粒细胞通过吞噬病原体和细胞碎片,清除骨损伤区域有害物质,清除有害物质,避免感染和炎症扩散,为后续细胞募集和再生创造 “清洁” 微环境[6, 8]。同时,其分泌的IL-6、CCL2等因子可招募单核细胞(巨噬细胞前体),间接调控MSCs迁移与分化。但中性粒细胞过度激活会引发慢性炎症,持续释放促炎因子,反而抑制成骨细胞功能,阻碍骨折愈合。
3~7天 巨噬细胞:骨再生的“调控开关”
中性粒细胞作用后,单核细胞会在趋化信号引导下迁移至损伤部位并分化为巨噬细胞。巨噬细胞(Macrophages)通过极化呈现M1、M2两种表型,作用截然不同[9, 10]。早期,巨噬细胞先以 M1 型(促炎表型)为主。M1 型巨噬细胞通过分泌 TNF-α、IFN-γ 等促炎因子,维持适度炎症反应,激活局部干细胞(如 MSCs)的迁移与增殖,同时通过 COX-2-PGE2 通路初步促进 MSCs 的成骨分化,为骨再生启动 “信号开关”。随着炎症逐渐受控,M1 型巨噬细胞会向 M2 型(抗炎表型)极化,M2 型巨噬细胞分泌的 TGF-β、BMP-2 等因子开始发挥主导作用,直接促进 MSCs 成骨相关基因表达,并抑制过度炎症,推动修复过程从 “炎症期” 向 “再生期” 过渡。
1~4周 T淋巴细胞:骨代谢的“平衡调节器”
当巨噬细胞完成炎症调控与早期成骨信号传递后,T 淋巴细胞(T cells)开始大量聚集并发挥作用,此阶段的核心是通过T细胞亚群的功能差异维持骨代谢平衡(图1)[7, 11]。

T细胞亚群功能差异显著,直接影响骨再生方向。Th1、Th17细胞为促炎亚型,Th1分泌的IFN-γ、TNF-α会抑制MSCs成骨分化,降低骨保护素(OPG)表达,升高RANKL/OPG比值,促进破骨;Th17分泌的IL-17则通过诱导MSCs表达RANKL,加速破骨细胞生成。Th2、调节性T细胞(Treg)为抗炎亚型,Th2分泌的IL-4、IL-13可上调OPG水平,抑制破骨细胞分化;Treg通过分泌TGF-β、IL-10,激活MSCs成骨相关通路,还能直接诱导巨噬细胞向M2型极化,双重促进骨形成。
数周至数月 肥大细胞:发挥重塑和微调作用
肥大细胞(Mast cells)功能具有两面性,一方面可分泌组胺、TNF-α等物质,促进破骨细胞生成并抑制成骨细胞活性,不利于骨再生;另一方面,其释放的TGF-β能增强MSCs增殖与迁移,IL-12还可减少破骨细胞形成。不过,目前肥大细胞对骨代谢的具体调控机制仍存在争议,不同动物模型中的研究结果尚未完全一致,需进一步探索。
第二部分:镁元素在骨修复中的免疫调控机制
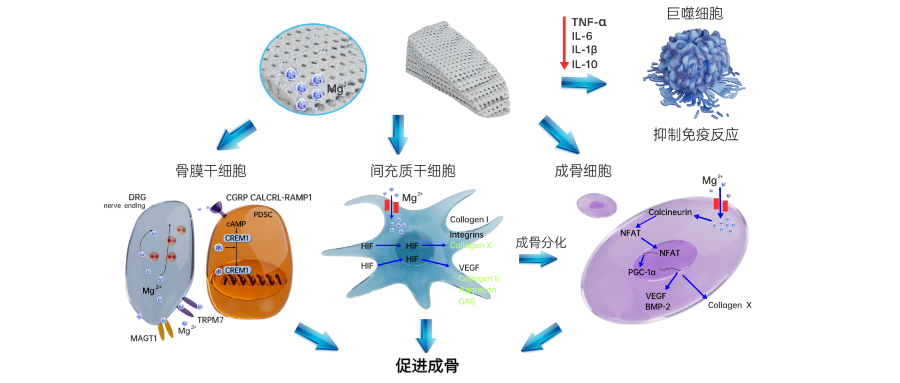
从2016年秦岭教授团队在《Nature Medicine》报道的《Implant-derived magnesium induces local neuronal production of CGRP to improve bone-fracture healing in rats》文章以来,复合镁元素的骨植入材料一直是生物材料学家们关注的重点,尤其是围绕着镁的骨免疫调节方面[12]。香港大学Kelvin W. K. Yeung研究团队发表在《Nature communications》的文章证实[13]:Mg2+诱导的骨再生是由巨噬细胞活动所介导的,具有双向作用模式。在早期炎症阶段Mg2+促进瞬时受体电位阳离子通道成员7(TRPM7)的上调从而形成促成骨免疫微环境;然而在后期骨重塑阶段,持续暴露的Mg2+会导致巨噬细胞中NF-κB信号的过度激活和破骨细胞数量的增加,此时Mg2+对成骨的负面影响可能会超过最初的促成骨作用。
此外,一项研究由 Yuya Dai等学者完成的工作发表于《Small》期刊,研究指出镁离子(Mg2+)可通过树突状细胞(DCs)上的 TRPM7 通道激活MAPK信号通路,进而诱导下游缺氧诱导因子-1α(HIF-1α)表达,通过HIF-1α-TGF-β轴促使DCs向免疫抑制表型(imDCs)极化,以此抑制CD4⁺ T细胞激活、增加调节性T细胞(Treg)形成,调控适应性免疫炎症,最终营造免疫抑制性骨微环境并促进骨修复[11]。这些结果表明:基于镁的骨生物材料设计需考虑其在骨愈合过程中的动态免疫调控作用。
临床应用上,深圳中科精诚医学科技有限公司的国家创新三类医疗器械,含镁可降解高分子骨修复材料产品(商品名:博骼列®,国械注准20253130952),是目前临床首款可用的,富含镁的骨修复产品,具有骨免疫调节潜力。其多中心临床试验表明:对比传统的β-TCP陶瓷产品,博骼列®具有更优异的早期骨愈合能力(12周骨融合速度快40%,24周植骨融合率达100%)[14]。背后的原因可能与博骼列®中镁离子的可控释放,建立起利于成骨的免疫微环境有关(图2)[15]。
参考文献:
1. Zhang, B., et al., Toward a Better Regeneration through Implant-Mediated Immunomodulation: Harnessing the Immune Responses. Advanced Science, 2021. 8(16): p. 2100446.
2. Luo, Y., et al., Strategic incorporation of metal ions in bone regenerative scaffolds: multifunctional platforms for advancing osteogenesis. Regenerative Biomaterials, 2025. 12.
3. Sun, Q., et al., The immunomodulatory effects and mechanisms of magnesium-containing implants in bone regeneration: A review. Journal of Magnesium and Alloys, 2024. 12(7): p. 2695-2710.
4. Burgan, J., et al., Innate immune response to bone fracture healing. Bone, 2025. 190: p. 117327.
5. Murayama, M., et al., The interactions of macrophages, lymphocytes, and mesenchymal stem cells during bone regeneration. Bone & Joint Research, 2024. 13(9): p. 462-473.
6. Liu, Y., et al., Neutrophils inhibit bone formation by directly contacting osteoblasts and suppressing osteogenic differentiation. Bone, 2025. 190: p. 117310.
7. Wang, H., et al., T cell related osteoimmunology in fracture healing: Potential targets for augmenting bone regeneration. Journal of Orthopaedic Translation, 2025. 51: p. 82-93.
8. Bastian, O.W., et al., Neutrophils contribute to fracture healing by synthesizing fibronectin+ extracellular matrix rapidly after injury. Clinical Immunology, 2016. 164: p. 78-84.
9. Wang, C., et al., Immunometabolism of macrophages in the bone microenvironment: a new perspective for bone healing therapy. Journal of Advanced Research, 2025.
10. Schlundt, C., et al., The multifaceted roles of macrophages in bone regeneration: A story of polarization, activation and time. Acta Biomaterialia, 2021. 133: p. 46-57.
11. Dai, Y., et al., Magnesium Ions Promote the Induction of Immunosuppressive Bone Microenvironment and Bone Repair through HIF-1α-TGF-β Axis in Dendritic Cells. Small, 2024. 20(33): p. 2311344.
12. Zhang, Y., et al., Implant-derived magnesium induces local neuronal production of CGRP to improve bone-fracture healing in rats. Nature Medicine, 2016. 22(10): p. 1160-1169.
13. Qiao, W., et al., TRPM7 kinase-mediated immunomodulation in macrophage plays a central role in magnesium ion-induced bone regeneration. Nature Communications, 2021. 12(1): p. 2885.
14. Gong, M., et al., Efficacy and safety of the low-temperature-derived 3D printed biodegradable Mg-containing composite porous scaffold for bone defect repair: A prospective and multi-center randomized controlled trial. Biomaterials, 2026. 327: p. 123751.
15. Lai, Y., et al., Osteogenic magnesium incorporated into PLGA/TCP porous scaffold by 3D printing for repairing challenging bone defect. Biomaterials, 2019. 197: p. 207-219.
西瓜柚子团队声明:文章内容来自同行评审研究;但这文章不能替代专业的医疗建议、诊断或治疗。

