3、镁是细胞“产能”的核心要素
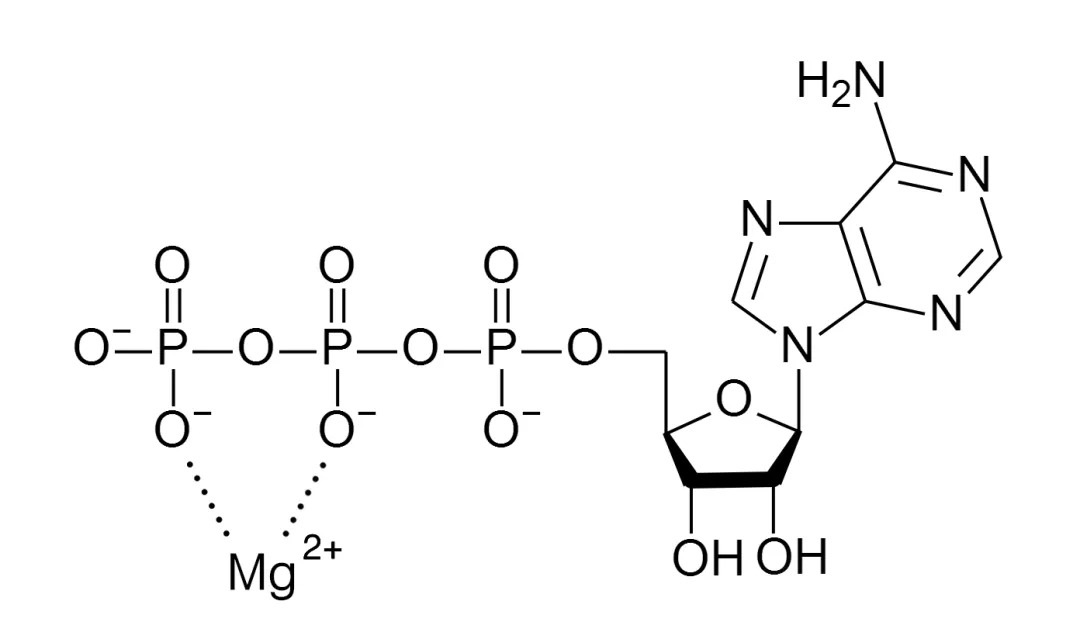
众所周知,ATP(adenosine triphosphate,三磷酸腺苷)是细胞内能量代谢的核心载体,通过其高能磷酸键的断裂与形成,实现能量的释放、转移和利用,为生物体各项生命活动(如物质合成、肌肉收缩、主动运输等)直接供能,是连接能量产生与消耗的关键分子。ATP 的稳定与活化离不开镁的存在。细胞内“可用的ATP”并非游离形式,而是以 Mg-ATP复合物(Mg-ATP complex,图1)参与反应,是ATP酶的真实底物,且催化过程中还需第二个Mg2+位点的辅助作用[6]。此外,ATP 分子上的三个磷酸基团带有高密度负电荷,彼此排斥,镁离子通过配位作用中和部分负电荷,使分子构象更稳定。Mg2+不仅是结构稳定剂,还能影响 ATP 的亲核性和磷酸转移速率,对能量代谢中的动力学参数有重要作用[7]。镁的血清浓度( 0.7至1.1 mmol/L)受肠道吸收与肾排泄精细调控,这种系统稳态保障了Mg-ATP复合物在细胞代谢中的持续可用性[8]。
其次,镁元素的缺乏是多种代谢性疾病的诱因。根据2024年医学顶刊《新英格兰医学杂志》的报道[9]:3%-10%的普通人群存在低镁血症,而2型糖尿病患者(10%-30%)和住院患者(10%-60%)的发病率更高,尤其是重症监护室的患者,其发病率超过65%。多个队列研究表明,低镁血症与全因死亡风险增加及心血管疾病相关死亡风险增加有关[10, 11]。Dibaba等人在2014年发表的文章中,荟萃分析了24473名参与者的数据,发现饮食镁摄入量与代谢综合征(metabolic syndrome,MetS)呈显著负相关:最高与最低镁摄入组相比,相对风险比为 0.69(95% CI 0.59–0.81);每额外摄入100 mg每天,MetS风险下降约17%(OR=0.83, 95%CI 0.77–0.89)[12]。Pelczyńska等人在2022年的综述中指出,慢性低镁参与包括肥胖、胰岛素抵抗、2 型糖尿病、高血压、脂质代谢异常和慢性低度炎症等多重代谢障碍的发病过程[13]。镁摄入足够与否,对限制脂肪积累、改善胰岛素与葡萄糖代谢、增强血管内皮功能、调节血脂和抑制炎症都有潜在积极作用。Piuri等2021年提出,正确的镁摄入模式有助于改善代谢综合征相关指标,包括降低血压、改善高血糖与高甘油三酯水平[14]。
4、镁强劲“赋能”骨修复过程
镁可以激活多种细胞的能量活力,免受高糖、低氧环境的影响,大大加速骨愈合能力。一项大鼠的研究表明:低镁饮食会导致血清甲状旁腺激素(parathyroid hormone,PTH)显著水平升高,同时全身骨量减少、皮质骨厚度降低,植入体内的种植体移除扭矩值降低[15]。临床前研究表明,外源性镁的加入可以激活干细胞线粒体功能,提高ATP能量产出。上交九院的Lin等人发现Mg2+通过多种能量代谢途径增强BMP-2的成骨活性:(1)Mg2+通过激活骨髓间充质干细胞(Bone Marrow Stem Cell,BMSC)中的Akt信号通路,促进糖酵解关键酶(如己糖激酶、磷酸果糖激酶)的活性,加速葡萄糖分解,快速生成ATP;(2)Mg2+通过线粒体膜上的Mrs2(mitochondrial RNA splicing 2),促进Mg2+进入线粒体,优化线粒体呼吸链复合体活性,提升氧化磷酸化效率,增加能量产出;(3)Mg2+协同 BMP-2 信号,不仅直接提升能量供应,还通过增强能量代谢状态,放大BMP-2对成骨相关基因(如 Runx2、Osterix)的激活作用,促进成骨分化[16]。Sun等人的体外研究表明:采用10 mM浓度的镁离子(Mg2+)处理衰老的BMSCs,无论是长期处理(从3代传至9代)还是短期处理(约72 h),均能显著改善其线粒体功能:使线粒体跨膜电位(ΔΨm)显著恢复,接近年轻P3代BMSCs水平;提升细胞内ATP含量,虽未完全恢复至年轻细胞水平,但较未处理的衰老细胞有统计学意义上的明显增加;同时减少活性氧(ROS)生成,降低幅度达统计学显著水平[17]。
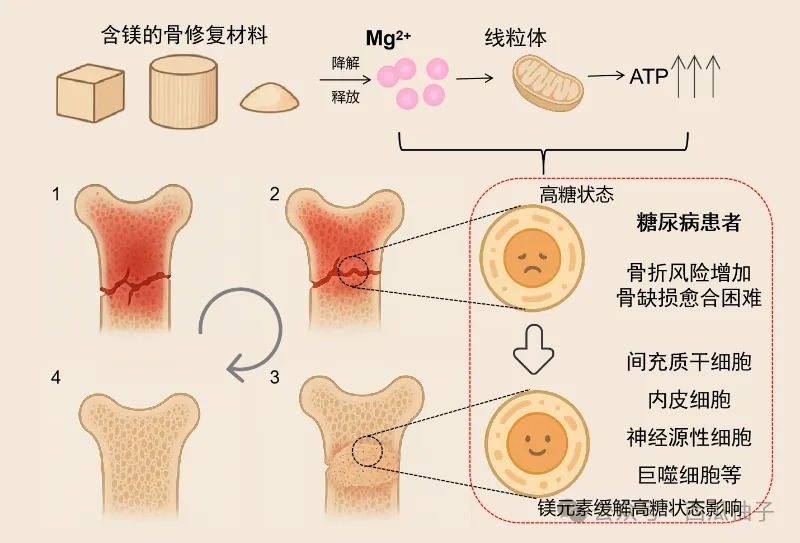
除了骨髓间充质干细胞,镁离子对神经源性细胞和巨噬细胞也有能量调节作用。香港中文大学秦岭教授团队联合内地及国际合作者研究发现,将超纯镁髓内钉固定物植入大鼠股骨远端后,其周围皮质区域形成了大量新骨;同时,在股骨周围皮质及同侧背根神经节中,神经元来源的降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)水平显著升高。体外实验进一步证实,镁离子可通过增加大鼠背根神经节神经元内的 ATP 浓度,促进肌动蛋白聚合,进而推动突触囊泡向神经末梢聚集,最终促进CGRP的释放,参与骨形成调控[18]。在另一项研究中[19],当巨噬细胞(THP1衍生的巨噬细胞)暴露于不同浓度的Mg2+时,细胞内ATP水平随Mg2+浓度升高而增加。这表明Mg2+可促进巨噬细胞的能量代谢活性,可能与其激活巨噬细胞功能(如吞噬、细胞因子分泌等)相关,为巨噬细胞在骨修复早期的免疫调节作用提供能量支持。
糖尿病患者的高血糖显著损害血管生成,阻碍成骨相关细胞获得氧气和营养物质,延迟骨愈合。Liu等人在《International Journal of Oral Science》杂志上的研究表明[20]:(1)在高糖环境下,血管内皮细胞的增殖能力受到显著抑制,而5 mmol/L的Mg2+能有效促进高糖环境下内皮细胞的增殖、迁移、成管;(2)高糖环境会导致内皮细胞内氧化应激水平升高,尤其是线粒体活性氧(reactive oxygen species,ROS)积累,而Mg2+能降低高糖环境下内皮细胞的氧化应激水平,减少线粒体 ROS 的积累,改善受损的线粒体质量,提高超氧化物歧化酶(superoxide dismutase,SOD)的活性。(3)体内实验表明,Mg涂层种植体能够促进糖尿病状态下受抑制的血管化和骨整合,对糖尿病小鼠的种植体骨整合有积极作用。
写在最后
据小编所知,精诚医学的含镁可降解高分子骨修复材料(博骼列®,国械注准20253130952)是市售唯一一款含有活性镁成分的骨修复材料。得益于镁元素在机体的能量代谢过程中发挥着重要作用,含镁的骨修复材料有望帮助患有基础代谢性疾病患者的骨缺损修复。
西瓜柚子团队声明:文章包含来自同行评审研究、医学协会和政府机构的信息;但这些文章不能替代专业的医疗建议、诊断或治疗。
*仅供医疗专业人士阅读
参考文献
1.刘建民, 等, 糖尿病患者骨折风险管理中国专家共识. 中华骨质疏松和骨矿盐疾病杂志, 2019. 12(04): p. 319-335.
2.Choi, I.A., et al., Bone metabolism–an underappreciated player. Npj Metabolic Health and Disease, 2024. 2(1): p. 12.
3.Karsenty, G. and S. Khosla, The crosstalk between bone remodeling and energy metabolism: a translational perspective. Cell Metabolism, 2022. 34(6): p. 805-817.
4.Miller, M.D., et al., Resting energy expenditure measured longitudinally following hip fracture compared to predictive equations: is an injury adjustment required? British Journal of Nutrition, 2005. 94(6): p. 976-982.
5.Sum, M., L. Mayer, and M.P. Warren, Bone mineral density accrual determines energy expenditure with refeeding in anorexia nervosa and supersedes return of menses. Journal of osteoporosis, 2011. 2011(1): p. 720328.
6.Syroeshkin, A., et al., Kinetic Mechanism of F~ o F~ 1 Mitochondrial ATPase: Mg2+ Requirement for Mg ATP Hydrolysis. Biochemistry-New York-English Translation of Biokhimiya, 1999. 64(10): p. 1128-1137.
7.Mubagwa, K., et al., Regulation of cation channels in cardiac and smooth muscle cells by intracellular magnesium. Archives of biochemistry and biophysics, 2007. 458(1): p. 73-89.
8.Kröse, J.L. and J.H. de Baaij, Magnesium biology. Nephrology Dialysis Transplantation, 2024. 39(12): p. 1965-1975.
9.Touyz, R.M., J.H. de Baaij, and J.G. Hoenderop, Magnesium disorders. New England Journal of Medicine, 2024. 390(21): p. 1998-2009.
10.Oost, L.J., et al., Serum magnesium is inversely associated with heart failure, atrial fibrillation, and microvascular complications in type 2 diabetes. Diabetes care, 2021. 44(8): p. 1757-1765.
11.Ye, L., et al., Association of magnesium depletion score with cardiovascular disease and its association with longitudinal mortality in patients with cardiovascular disease. Journal of the American Heart Association, 2023. 12(18): p. e030077.
12.Dibaba, D.T., et al., Dietary magnesium intake and risk of metabolic syndrome: a meta‐analysis. Diabetic Medicine, 2014. 31(11): p. 1301-1309.
13.Pelczyńska, M., M. Moszak, and P. Bogdański, The role of magnesium in the pathogenesis of metabolic disorders. Nutrients, 2022. 14(9): p. 1714.
14.Piuri, G., et al., Magnesium in obesity, metabolic syndrome, and type 2 diabetes. Nutrients, 2021. 13(2): p. 320.
15.Belluci, M.M., et al., Effects of magnesium intake deficiency on bone metabolism and bone tissue around osseointegrated implants. Clinical oral implants research, 2011. 22(7): p. 716-721.
16.Lin, S., et al., Orchestration of energy metabolism and osteogenesis by Mg2+ facilitates low-dose BMP-2-driven regeneration. Bioactive materials, 2022. 18: p. 116-127.
17.Sun, M., et al., Magnesium Promoting OVX Rats’ Rotator Cuff Tear Repair With Relieving Stem Cell Senescence Effect. Experimental Cell Research, 2025: p. 114593.
18.Zhang, Y., et al., Implant-derived magnesium induces local neuronal production of CGRP to improve bone-fracture healing in rats. Nature medicine, 2016. 22(10): p. 1160-1169.
19.Qiao, W., et al., TRPM7 kinase-mediated immunomodulation in macrophage plays a central role in magnesium ion-induced bone regeneration. Nature Communications, 2021. 12(1): p. 2885.
20.Liu, L., et al., Magnesium promotes vascularization and osseointegration in diabetic states. International Journal of Oral Science, 2024. 16(1): p. 10.
以上内容转载自“西瓜柚子微信公众号”

